Suyun yoğunluğu, birim hacme düşen su kütlesi olup özkütle olarak ta tanımlanır. Moleküler yapıdaki her maddenin yoğunluğu yani özkütlesi vardır. Yoğunluk formülü;
d = M / V dir.
d: Yoğunluk
M: Cismin kütlesi
V: Cismin hacmi
Suyun yoğunluğu sıcaklığa göre değişmekte olup 1 gr/cm³ olarak bilinmektedir. Bu değer, 4 ℃ sıcaklıkta deniz seviyesinde atmosfer basıncındaki özkütle değeridir. Sıcaklık arttıkça hacim artar ve yoğunluk azalır. Su (H2O) kaynatıldığında genleşme olur ve suyun yoğunluğu azalarak ağırlığında düşüş yaşanır.
Formülü: H2O
Kaynama Noktası: 100 ℃
Erime Noktası: 0 ℃
Yoğunluğu: 1.000 kg/ m³
Moleküler Ağırlık: 18,01528 g/mol
Suyun Yoğunluğu
Suyun yoğunluğu, ısı arttıkça düşmeye başlar. 0 ℃ den 4 ℃ ye gelindiğinde ise özkütle artar. Bunun nedeni, 2 hidrojen ve 1 oksijenden oluşan suyun içerisindeki hidrojen moleküllerinin birbiriyle bağlanma şeklidir. Su donduğunda kristal yapıda olup moleküller arasında boşluklar meydana gelir. Bu nedenle daha fazla yer kaplar. Hacmi artar, yoğunluğu azalır.
Sıcaklığa göre suyun yoğunluğu;
- 0 ℃ de 0.99987 gr/cm3
- 4 ℃ de 1,00000 gr/cm3
- 4,4 ℃ de 0,99999 gr/cm3
- 10 ℃ de 0,99975 gr/cm3
- 21 ℃ de 0,99802 gr/cm3
- 32,2 ℃ de 0,99510 gr/cm3
- 60 ℃ de 0,98338 gr/cm3
- 71,1 ℃ de 0,97729 gr/cm3
- 82,2 ℃ de 0,97056 gr/cm3
- 93,3 ℃ de 0,96333 gr/cm3
- 100 ℃ de 0,95865 gr/cm3
Yaşam için vazgeçilmez bir sıvı olan su dünyada bolca bulunur. Tatsız ve kokusuz olup suyun en saf hali yağmur suyudur. Saf suyun canlılara bir faydası olmayıp içmek için kullanılmaz.
Suyun Sıcaklık Yoğunluğu Grafiği

Su yoğunluğunun (özkütlenin) +4 ℃ den sonra artmaya başladığını söylemiştik. Bunun nedenini de 2 hidrojen ve 1 oksijenden oluşan suyun içerisindeki hidrojen moleküllerinin birbiriyle bağlanma şekli olduğunu belirtmiştik. Hacim sıcaklık ve özkütle sıcaklık grafiğinde sıcaklığa göre değişen hacim ve özkütle değerleri görülüyor.
Aşağıdaki grafikte ise +4 ℃ de su yoğunluğunun maksimum seviyesi görülüyor.

Buzluğa konan su şişesi, suyun hacmi arttığından dolayı çıkartıldığında çatlar, kırılır. d=m/v formülü, hacim ve özkütlenin ters orantılı olduğunu göstermektedir. Yani donan suyun molekülleri birbirinden uzaklaşır ve hacmi artar. Buna karşın özkütlesi yani yoğunluğu azalır. Donan bir göl veya su birikintisi üzerinde yüzen buz parçaları da yoğunluğu azalmış olan su molekülleridir.
Su Molekülleri +4 ℃ de Farklılaşıyor
Su moleküllerini diğer moleküllerden farklı kılan özellik, katı hale geçtiğinde yani donduğunda yoğunluğunun artmasıdır. Bu özelliği ile sıcaklık düşüp su donmaya başladığında katılaşan moleküller su yüzeyine çıkar. Diğer kimyasal element ve bileşen moleküllerinde ise durum farklıdır. Katılaşan moleküller dibe çöker. Su soğudukça moleküller birbirine yaklaşmaktadır. En büyük yoğunluk ise +4 ℃ de yakalanır. Yani su en yüksek yoğunluğa +4 ℃ de ulaşır. Su molekülleri en yoğun +4 ℃ de bulunur. +4 ℃ den sonra grafikte de görüldüğü gibi özkütle (yoğunluk) tekrar düşmeye başlar.

 Türkçe
Türkçe Engilsh
Engilsh














































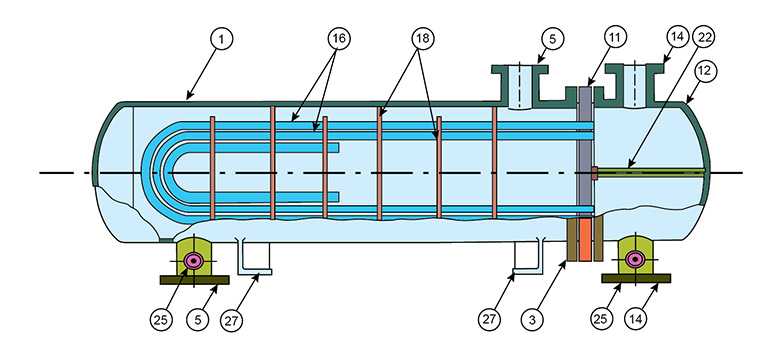














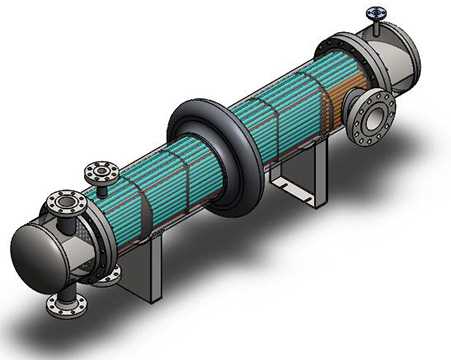



































































Tüm Yorumlar